magazine_ Interview
Mein Name ist Elegance, C. Elegance
Wie ein winziger Fadenwurm Erkenntnisse zu den Mechanismen der Parkinson-Krankheit ermöglicht
Der Fadenwurm Caenorhabditis elegans dient in verschiedenen biomedizinischen Studien als Modellorganismus. Welche Rolle er bei der Erforschung der Parkinson-Krankheit spielen kann, erklärt der Experte Roman Vozdek.
Durchsichtige Würmer, auch Fadenwürmer oder Nematoden genannt, kommen überall vor. Meist handelt es sich um mikroskopische Würmer, die sich an unterschiedlichste Lebensräumen angepasst haben, vom Boden der Antarktis bis zum Inneren unseres Darms. Sie kommen in so vielen Mikroumgebungen vor, dass der Nematologe Nathan Cobb einmal sagte: „Würde die gesamte Materie im Universum weggefegt und nur die Nematoden blieben verschont, wären die Umrisse unserer Welt immer noch zu erkennen.“ In letzter Zeit haben Fadenwürmer häufig für Schlagzeilen gesorgt: von der Entdeckung von 46.000 Jahre alten Exemplaren, die im sibirischen Permafrost eingeschlossen waren und wieder zum Leben erweckt wurden, über den fleischfressenden Austernpilz, der sich von Nematoden ernährt, indem er ihnen ein Nervengas injiziert, bis hin zur Tatsache, dass es sich bei diesen Würmern um eine der fruchtbarsten Arten auf unserem Planeten handelt. Es sollte also nicht überraschen, dass z.B. die Haut einer Seekuh etwa eine halbe Million Fadenwürmer beherbergt. C. elegans ist nur eine von vielen Fadenwurmarten, aber eine der bekanntesten und interessantesten. Mit einer Größe von nur einem Millimeter vom Kopf bis zum Schwanz lebt C. elegans normalerweise im Boden und ernährt sich von Bakterien und anderen Mikroorganismen. Die meisten erwachsenen Tiere sind Hermaphroditen, die durch Selbstbefruchtung hunderte Nachkommen zeugen. Ein einziger Fadenwurm kann in einer Woche bis zu 1000 Nachkommen hervorbringen. Roman Vozdek ist Biochemiker und biomedizinischer Ingenieur sowie der erste und einzige Nematologe am Institut für Biomedizin von Eurac Research, wo er das erste C. elegans-Labor in Bozen eingerichtet hat. Er erklärt uns, wie diese mikroskopisch kleinen Wunderwerke helfen können, Entstehung und Fortschreiten der Parkinson-Krankheit zu entschlüsseln.
Wie sieht für Sie ein typischer Tag aus?
Roman Vozdek: Im Labor halten wir die Würmer auf Petriplatten, und wenn ich morgens komme, prüfe ich als erstes die Platten, die mich gerade am meisten interessieren. Wollte ich beispielsweise zwei Tage zuvor Würmer kreuzen, prüfe ich, ob sie sich tatsächlich gekreuzt haben. Manchmal tun sie das nämlich nicht – dann muss ich die Paarung erneut vorbereiten.
Mit Kerzen und romantischer Musik?
Roman: Ha. Sie hören eigentlich sehr viel Pearl Jam. Für die Kreuzung setze ich Männchen einer Sorte auf die Platte mit den Hermaphroditen einer anderen Sorte und prüfe dann, ob es Nachkommen der beiden ursprünglichen Genotypen gibt. Normalerweise überprüfe ich den Genotyp dieser Würmer durch eine Amplifikation der DNA mittels Polymerase-Kettenreaktion, auch PCR-Test genannt. Manchmal geht das aber auch relativ schnell mit dem Mikroskop. Dann wende ich mich den anderen Platten zu – wenn ich mehrere Experimente gleichzeitig durchführe, überprüfe ich, wie jedes davon läuft, und untersuche, ob der von mir erwartete Phänotyp auftritt. Ich verwende auch einige biochemische Techniken, um die Genfunktionen zu untersuchen; im Grunde verbringe ich den ganzen Tag im Labor, um alle Experimente erfolgreich voranzubringen.
Und Sie zeichnen auf, was Sie beobachten?
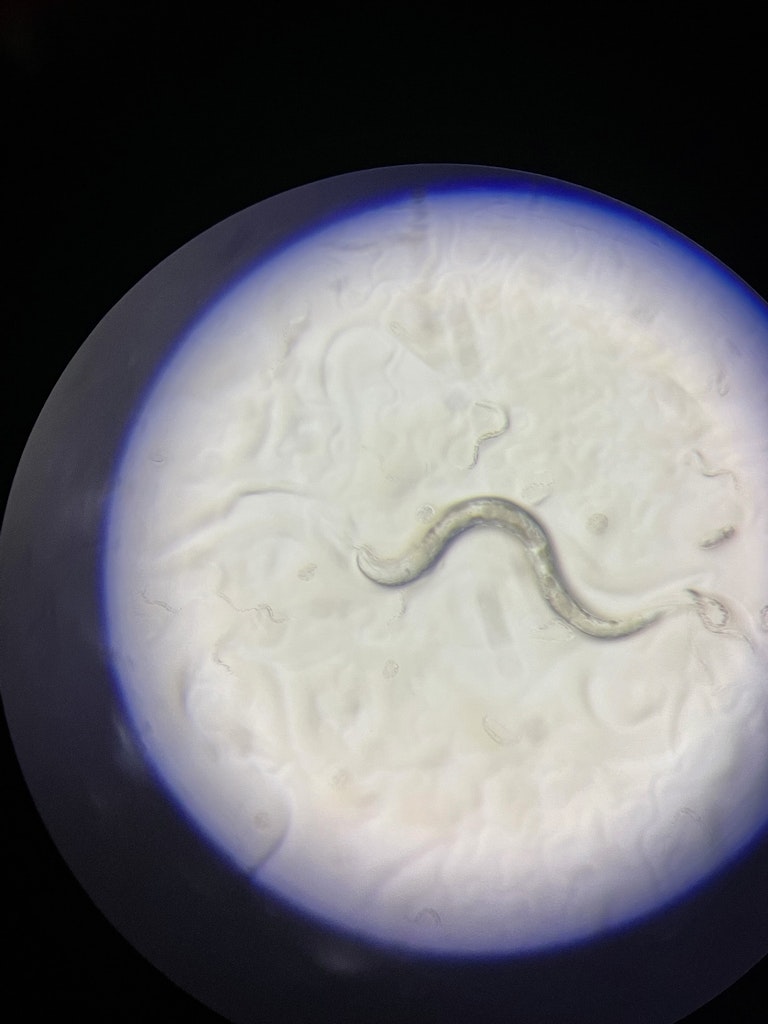
Roman: Ich mache Fotos von den Würmern oder Videos von ihrem Verhalten. Würmer können sich je nach den Bedingungen ganz unterschiedlich verhalten. Man kann untersuchen, wie schnell sie krabbeln und wie sie auf Stress reagieren. Stressfaktoren können chemisch, mechanisch oder durch die Temperatur beeinflusst werden. Man kann den Phänotyp der Würmer bestimmen – beispielsweise ob sie Futtersucher sind oder ob ihnen der Sinn für die Nahrungsauffindung fehlt. Man kann analysieren, wie sie schwimmen und allgemein wie sie auf Flüssigkeit reagieren. Die Würmer sind vollständige Organismen mit Muskeln, Neuronen, Haut usw. Mittels der so genannten konfokalen Mikroskopie kann man ein detailliertes Bild erhalten, indem man Gewebe schichtweise optisch abtastet und dann ein dreidimensionales Bild erstellt. Das alles wird gemacht, während der Wurm ruhiggestellt ist, weil er sonst überall herumkrabbelt. Das Wichtigste ist: Die Würmer sind lebendig. Wir können an ihnen also biologische Vorgänge in-vivo untersuchen, das heißt in einem lebenden Organismus.
C. elegans: in-vivo
© Eurac Research | Annelie Bortolotti
Woher bekommen Sie die Würmer?
Roman: Sie leben in den meisten Bodenarten und sind auf allen Kontinenten zu finden. Man muss nur durch ein Mikroskop schauen, um sie zu sehen. Der berühmteste Vertreter, C. elegans, wurde in Bristol in Großbritannien isoliert; das ist der ursprüngliche Wildstamm von C. elegans, der in allen Forschungslabors als Referenzstamm verwendet wird. Aber jetzt wissen wir, dass es haufenweise Wildstämme gibt, weil man diese Würmer überall auf der Welt isolieren kann. Eine Gruppe von Wurmexperten hat ein C. elegans-Depot eingerichtet, in dem die in den verschiedenen Labors auf der ganzen Welt erzeugten Würmer gesammelt und bei Interesse weitergegeben werden. Man kann die Stämme auch direkt mit anderen Labors teilen. Die Wurm-Community ist sehr großzügig und freundlich. Wer in einem registrierten C. elegans-Labor arbeitet, kann Würmer ganz einfach von anderen Labors oder von einem Depot bekommen. Als ich anfing, mit Würmern zu arbeiten, kostete ein Stamm sieben Dollar, jetzt sind es etwa zehn Dollar. Die Würmer werden auf Petriplatten versendet, weil sie den Transport überleben müssen, Hunderte auf einer Platte; normalerweise sind sie wochenlang unterwegs, weil sie am Zoll hängen bleiben. Aber für die Würmer ist das kein Problem, sie können monatelang ohne Nahrung auskommen. Ein Stamm bedeutet ein bestimmter Genotyp – bei allen Würmern eines Stamms ist die DNA die gleiche. In den vergangenen vier Jahren habe ich schon mehr als 100 verschiedene Stämme bestellt und mehr als 300 selbst geschaffen.
Wie bekommt man das Parkinson-Gen in den Wurm?
Roman: In unserem Fall habe ich ein menschliches Gen verwendet, das für ein Protein namens Alpha-Synuclein kodiert; die Agggregation dieses Proteins ist für Neuronen giftig und wird auch mit familiären Formen von Parkinson in Verbindung gebracht. Ich habe dieses menschliche Gen zwischen jene Teile der C. elegans-DNA eingefügt, die dafür sorgen, dass das Gen nur in bestimmten C. elegans-Neuronen aktiv ist. Man kann DNA in die Keimdrüse des Wurms injizieren; die Eier nehmen sie dann als ihre eigene auf. Würmer, die dieses menschliche Gen in sich tragen, zeigen zwar eine Neurodegeneration, haben aber keine klassischen Parkinson-Symptome, wie etwa Zittern, da dies mit der menschlichen Biologie zusammenhängt.
.
Und warum gerade Würmer?
Roman: In meiner Doktorarbeit, noch in Prag, beschäftigte ich mich mit der Rolle einiger C. elegans-Gene im Schwefelwasserstoff-Stoffwechsel. Wir entdeckten wirklich interessante und unerwartete Funktionen dieser Gene, und mir wurde klar, was für ein cooles Instrument dieser Wurm für die Forschung ist, und ich wollte die Biologie von C. elegans weiter erforschen. Nach meiner Promotion ging ich in die USA, wo ich an einer Studie mit echten Würmern arbeitete, nicht nur mit ihrer DNA oder ihren Proteinen. Wir arbeiteten an einem Protein, das in bemerkenswerter Weise das Überleben von dopaminergen Neuronen fördert. Dopaminerge Neuronen sind jene Nervenzellen im Gehirn, die Dopamin produzieren und die bei der Parkinson-Krankheit absterben. So begann ich mich für Neurodegeneration zu interessieren. Ich setzte mich mit Andrew Hicks, dem stellvertretenden Leiter des Instituts für Biomedizin, in Verbindung; er forscht mit Zellen von Parkinson-Patienten, und ich fragte ihn, ob er interessiert wäre, Würmer zu verwenden, um die Krankheit besser zu verstehen. C. elegans ist ein komplexes lebendes Modell zur Untersuchung der grundlegenden Biologie von Genen, die mit der Parkinson-Krankheit in Verbindung stehen. Es ermöglicht nämlich auf einfache, unkomplizierte und kostengünstige Weise herauszufinden, was diese Gene tun. Dann kann man sich die menschliche Biologie ansehen: Ist sie identisch oder nicht? Vieles, was man in Würmern beobachtet, gibt es auch beim Menschen.
Ich habe von Fadenwürmern gehört, die nach 46.000 Jahren im Permafrostboden wieder zum Leben erweckt wurden.
Roman: Ja, das ist ein weiterer Vorteil. Man kann Fadenwürmer tatsächlich einfrieren, so wie wir es regelmäßig mit verschiedenen Bakterienstämmen machen. Mit Würmern kann man das Gleiche machen, das ist ein sehr großer Vorteil dieses Modells. Man kann sie einfrieren und nach Jahren wieder auftauen, und sie sind immer noch am Leben.
Können Sie die wissenschaftlichen Zusammenhänge für Laien wie mich erklären? Was ist das Ziel dieses spezifischen Projekts?
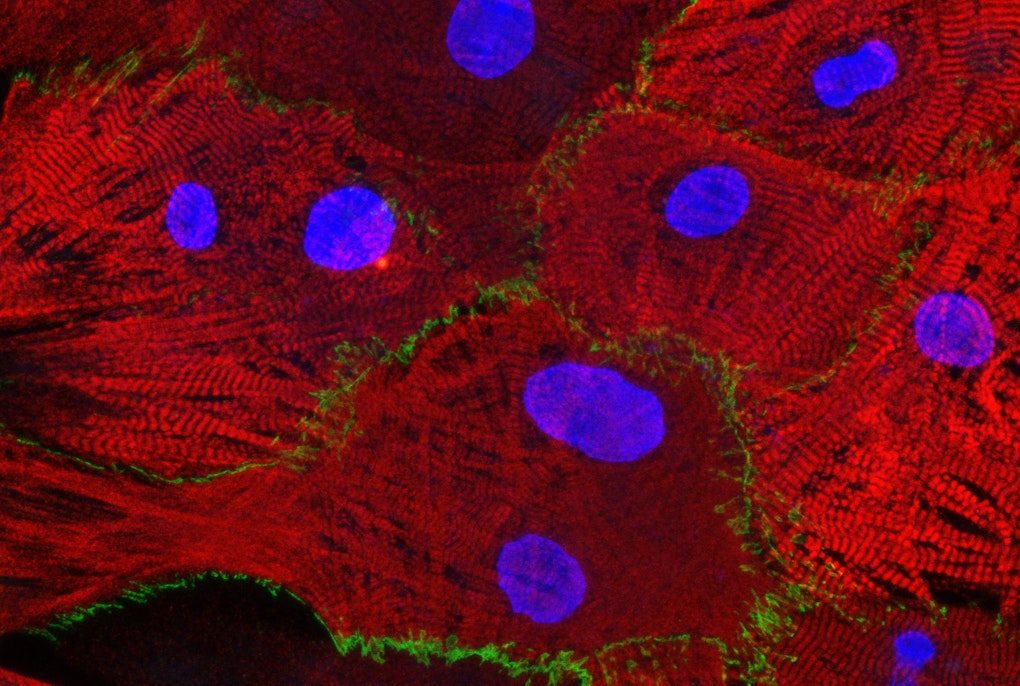
Roman: Das pathologische Merkmal der Parkinson-Krankheit sind die Lewy-Körperchen, abnorme Proteinansammlungen im Gehirn, die ein aggregiertes Protein namens Alpha-Synuclein enthalten. Wie ich schon sagte: Wenn der Wurm das Gen für Alpha-Synuclein in sich trägt und man es in den Neuronen aktiviert, dann degenerieren sie. Wir untersuchen also mit Hilfe eines Wurm-Modells der Parkinson-Krankheit mit degenerierten dopaminergen Neuronen, welche Rolle bestimmte Gene bei der Neurodegeneration spielen oder welche Wirkung bestimmte Metaboliten und Chemikalien haben. Auf diese Weise könnte es gelingen, grundlegende neuroprotektive Mechanismen zu entdecken, die auch beim Menschen evolutionär erhalten geblieben sind. Allerdings gab es in keinem der Depots oder Labors einen Stamm, in dem man beobachten konnte, wie dieses Protein aggregiert oder wo es innerhalb des Neurons exprimiert wird. Ich habe also zuerst diesen Wurm geschaffen, bei dem das Alpha-Synuclein-Protein mit einem Floureszenzstoff markiert ist. Ich verwendete dafür Moleküle mit verschiedenen Farben: Grün, um das Alpha-Synuclein sichtbar zu machen – damit kann man beobachten was es tut, wo es sich im Neuron ansammelt, wo es exprimiert wird, unter welchen Bedingungen es sich nicht ansammelt usw.; und Rot für die Neuronen – um genau zu sehen, wo sie sind und wie ihre Morphologie aussieht. Dieser Wurmstamm ist inzwischen recht beliebt und wird in mehreren Labors auf der ganzen Welt eingesetzt. Auf diese Weise kann man Organellen, Zellen und ganze Gewebe darstellen. Man kann einzelne Proteine mit diesen fluoreszierenden Markierungen sichtbar machen und einen lebenden Organismus dabei wirklich im Detail beobachten. In unserem Labor verwende ich verschiedene solche C. elegans-Modelle für die Parkinson-Krankheit und untersuche, welche Rolle in diesen Wurm-Modellen bestimmte Gene spielen, die mit der Krankheit in Verbindung stehen. Wir haben sowohl neuroprotektive als auch neurotoxische Gene identifiziert, und gemeinsam mit den Kollegen am Institut werden wir ihre Rolle in menschlichen Zellmodellen weiter untersuchen, um zu bewerten, welche dieser Gene als therapeutische Ziele für die Parkinson-Krankheit in Frage kommen.
Nematoden und der Nobelpreis
Im Jahr 2002 erhielten John Sulston, Sydney Brenner und Bob Horvitz gemeinsam den Medizin-Nobelpreis für ihre Entdeckungen auf dem Gebiet der „genetischen Regulierung der Organentwicklung und des programmierten Zelltods“, also für ihre Erkenntnisse zu der Frage, welche Zellen bei der Entwicklung eines mehrzelligen Lebewesens sich weiter teilen und welche gezielt absterben. Studien am Fadenwurm C. elegans führten zu einer grundlegenden Neubewertung der Bedeutung von Genen, die an der gezielten Tötung bestimmter Zellen während der normalen Entwicklung beteiligt sind. Sydney Brenner untersuchte den transparenten Fadenwurm, um zu verstehen, wie Gene die Entwicklung eines befruchteten Eis steuern. In einer Reihe wissenschaftlicher Veröffentlichungen zeichnete das Team das Schicksal jeder Fadenwurmzelle nach und beschrieb die einzelnen Schritte des programmierten Zelltods; dabei wiesen es die ersten genetischen Mutationen nach, die an diesem Prozess beteiligt sind, und identifizierte die ersten beiden echten „Todesgene“ – ced-3 und ced-4, die auch das menschliche Genom enthält.
Einige Organismen, wie z.B. Quallen, "leuchten", weil sie ein schimmerndes Licht aussenden, das als grün fluoreszierendes Protein (GFP) bezeichnet wird. Das fluoreszierende grüne Protein konnte aus Quallen isoliert werden. Im Jahr 2008 erhielt Martin Chalfie den Nobelpreis für seine Entdeckungen, die es ihm ermöglichten, das GFP-Gen in C. elegans einzufügen und damit sechs einzelne Zellen zu „färben“ und somit ihre Entwicklung zu verfolgen.
Warum *C. elegans*
Der Fadenwurm C. elegans ist das perfekte Studienobjekt, um zu untersuchen, wie aus dem genetischen Code der DNA ein vollständiger Organismus entsteht. Der Wurm kann in nur drei Tagen vom Ei zum erwachsenen Tier heranwachsen, und jedes ausgewachsene Exemplar hat genau 959 Zellen. Aufgrund der raschen Entwicklung, die sich unter dem Mikroskop leicht beobachten lässt, kann man untersuchen, was mit jeder einzelnen Fadenwurmzelle im Laufe eines vollständigen Lebenszyklus geschieht. Wissenschaftler mögen den Fadenwurm, weil er sich leicht im Labor halten lässt, sich gerne von Bakterien ernährt, die in einer Petrischale wachsen, und einen bemerkenswert einfachen Körperbau hat. Diese Einfachheit hilft zu verstehen, wie ein mehrzelliger Organismus aus genetischer Information entsteht, die in der DNA kodiert ist. Viele der biologischen Abläufe sind von diesen Würmern bis zum Menschen konserviert, was es ermöglicht, menschliche Krankheiten damit zu studieren.
Roman Vozdek
Der Biochemiker und biomedizinische Ingenieur Roman Vozdek sammelte Erfahrungen in Labors für die Erforschung von C. elegans-Nematoden am MIT (Massachusetts Institute of Technology, in Boston, USA) und an der UCSF (University of California San Francisco, USA). Er nutzt diese Fadenwürmer, um neue therapeutische Ziele für die Behandlung von Krankheiten zu finden, die mit oxidativem Stress einhergehen, darunter die Parkinson-Krankheit. Nach seinem Masterabschluss in Biochemie und Biomedizin identifizierte er in seiner Doktorarbeit und als Postdoktorand genetische Signalwege und molekulare Mechanismen, die die zelluläre Anpassung an Hypoxie und oxidativen Stress im Fadenwurm C. elegans ermöglichen. Er hat zahlreiche Stipendien erhalten und in Nature communication, Science signaling und Frontiers in Aging Neuroscience veröffentlicht. Er gründete das C. elegans-Labor bei Eurac Research, um mit Hilfe der Genetik des Wurms neue Mechanismen der Neurodegeneration zu entschlüsseln. Das Projekt STANIMON wurde durch das internationale Mobilitätsstipendium der Autonomen Provinz Bozen - CUP D55F21004130003 - finanziert.